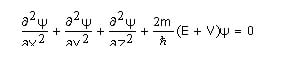Teori Atom Menurut Para Ahli dan Partikel Penyusun Atom – Atom mempunyai asal kata dari bahasa Yunani atomos yang artinya tidak bisa dibagi. Democritus di awal abad 4 SM menemukan konsep dasar atom.
Democritus memandang bahwa sebuah benda dapat dibagi hingga menajadi bagian yang sangat kecil hingga akhirnya tidak bisa dibagi lagi (atom). Menurutnya, atom tidak seutuhnya padat, tak berstruktur internal dan memiliki rang kosong antar-atom sebagai tempat pergerakannya.
Teori Atom Menurut Para Ahli dan Partikel Penyusun Atom
Atom bisa dibedakan menurut ukuran, massa dan bentuk. Semua benda tersusun dari atom.
Teori-Teori Atom Menurut Ahli
Selain Democritus, ada ahli-ahli lain yang mengemukakan teori atom sebagai berikut.
Model Teori Atom John Dalton
John Dalton (1803) mengungkapkan dasar hukum atom yakni hukum kekekalan massa (Hukum Lavoisier) yang berbunyi “massa total zat-zat sebelum reaksi selalu sama dengan massa total zat-zat hasil rekasi” dan hukum susunan tetap (Hukum Prouts) yang bunyinya “perbandingan massa unsur-unsur dalam sebuah senyawa akan selalu tetap”.
Berdasarkan dua hukum di atas, Dalton memiliki pandangannya tentang atom seperti berikut :
- Atom adalah bagian terkecil suatu materi yang tidak bisa lagi dibagi.
- Atom dijelaskan sebagai bola pejal yang amat kecil dimana sebuah unsur mempunyai atom-atom identik dan berbeda untuk unsur berbeda.
- Atom-atom berkumpul membentuk senyawa yang perbandingannya berupa bilangan bulat sederhana.
- Reaksi kimia adalah penggabungan atau pemisahan atau penyusunan kembali atom-atom sehingga atom tidak bisa dimusnahkan atau diciptakan.
Teori ini mempunyai kelebihan untuk mulai menumbuhkan minat akan penelitian model atom. Namun, kekurangannya yaitu teori ini tidak menjelaskan larutan yang bisa menghantarkan listrik. Bola pejal tidak menghantarkan arus listrik sehingga terdapat partikel lain yang mampu menghantarkan listrik.
Model Teori Atom J. J. Thomson
J. Thomson (awal 1900-an) mengemukakan teorinya tentang atom dimana ada partikel proton dan elektron di dalam atom dan massa proton jauh lebih besar daripada elektron menurut hasil penelitiannya. Model atom Thomson menjelaskan proton tunggal yang besar.
Ada elektron penetral muatan positif di dalam proton. Menurutnya, atom tersusun dari bulatan bermuatan positif dan rapat muatannya merata. Terdapat elektron-elektron bermuatan negatif yang sama besarnya dengan muatan positif dalam atom.
Thomson mengungkapkan bahwa atom adalah bola pejal bermuatan positif dengan muatan negatif elektron di dalamnya. Model atom ini diumpamakan dengan jambu biji yang dikupas kulitnya di mana ada sebaran merata biji jambu sebagai elektron serta daging jambu bulat sebagai proton.
Kelebihan teori ini yaitu mampu mebuktikan ada partikel lain di dalam atom dengan muatan negatif sehingga atom bukan bagian terkecil sebuah unsur. Kelemahan teori ini yaitu tidak menerangkan susunan muatan positif dalam bola atom.
Model Teori Atom Rutherford
Rutherford (1910) bersama Geiger dan Masreden mengadakan eksperimen hamburan sinar alfa (λ) pada lepemng tipis emas dan menemukan sebagian besar partikel alfa bisa menembus lemeng emas tanpa dibelokkan.
Rutherfor juga menemukan sedikit pembelokan alfa serta partikel-partikel alfa yang dibelokkan pada sudut yang amat tajam kembali menuju sumber radioakrif. Lalu, Rutherford mengembangkan model inti atom untuk menjelaskan sebagian besar partikel alfa yang mampu menembus lempeng emas tanpa dibelokkan.
Atom Rutherford
Rutherford menarik beberapa kesimpulan sesuai gejala yang timbul yakni :
- Atom bukanlah bola pejal sebab sebagian besar partikel alfa diteruskan.
- Apabila lempeng emas dianggap sebuah lapisan atom emas, maka ada partikel sangat kecil bermuatan positif di dalam emas.
- Partikel tersebut menyusun sebuah inti atom yang menurut fakta 1 dari 20.000 partikel alfa dibelokkan. Jika perbandingan tersebut adalah perbandingan diameter, maka diperkirakan inti atom berukuran sekitar 10.000 kali lebih kecil dari ukuran atom keseluruhan.
Model atom Rutherford beranggapan bahwa atom tersusun dari inti atom yang amat kecil bermuatan positif dan ada elektron bermuatan negatif yang mengelilingi. Kelebihan teori ini yaitu adanya hipotesa atom terdiri dari inti atom dan elektron di sekeliling inti.
Gagasan ini mengilhami penemuan berikutnya mengenai kedudukan elektron (kulit elektron). Kelemahan teori ini yaitu tidak menerangkan alasan elektron tidak jatuh ke inti atom.
Model Teori Atom Niehls Bohr
Niehls Bohr (1913) memperbaiki kegagalan eksperimen Rutherford melalui penelitiannya mengenai spektrum atom hidrogen dengan hasil kedudukan orbit elektron yang menempati wilayah sekeliling inti atom. Elektron mengitari inti atom dengan orbit tertentu dan hanya ada sejumlah orbit serta perbedaan antar-orbit yaitu jarak orbit dengan inti atom.

Kedudukan elektron di orbit bergantung pada tingkat energi elektron. Elektron di orbit rendah berenergi lebih kecil dibandingkan elektron di orbit tinggi.
Atom Niehls Bohr
Bohr menggabungkan teori klasik Rutherford dan teori kuantum Planck sehingga berpendapat bahwa :
- Elektron dalam atom bergerak mengitari inti di orbit tertentu dan tidak memancarkan energi. Orbit-orbit tersebut dinamakan kulit atau tingkat energi elektron.
- Elektron bisa berpindah-pindah orbit.
- Perpindahan elektron dari tingkat tinggi menuju rendah diikuti pencaran energi, sedangkan perpindahakn dari tingkat rendah menuju tinggi diikuti penyerapan energi.
- Elektron yang mengorbit bersifat stasioner berarti elektron tidak menyerap atau memancarkan energi.
Tingkat energi terendah ialah kulit elektron terdalam. Tingkat energi makin tinggi jika makin besar nomor kulitnya. Kelebihan teori ini yaitu atom mempunyai kulit-kulit sebagai tempat perpindahan elektron. Kelemahan teori ini yaitu tidak menerangkan efek strack dan efek Zeeman.
Model Atom Modern
Werner Hensberg mengemukakan teori mekanika kuantum dengan prinsip ketidakpastiannya yang berbunyi “momentum dan kedudukan sebuah benda tidak mungkin bersamaan secara seksama, kebolehjadian menemukan elektron dengan jarak tertentu dari inti atomlah yang bisa ditentukan”.
Wilayah sekeliling inti dengan kemungkinan memperoleh elektron dinamakan orbital. Erwin Schrodinger merusmukan tingkat dan bentuk tingkat energi orbital dan memecahkan sebuah persamaan guna memperoleh fungsi gelombang demi menerangkan batas kemungkinan diketahuinya elektron dalam 3 dimensi.
Keterangan :
x, y, z : kedudukan dalam tiga dimensi
y : fungsi gelombang
m : masaa
ђ : h/2 , h (konstanta Planck) dan p (3,14)
e : energi total
V : energi potensial
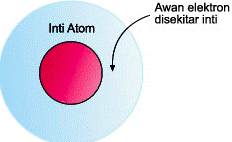
Model atom dengan lintasan orbital tersebut dinamakan model atom modern (model atom mekanika kuantum) dan berlaku hingga sekarang yang dijelaskan dengan gambar berikut.
Tempat kemungkinan elektron ditunjukkan oleh awan elektron di sekitar inti. Tingkat energi elektron ditunjukkan oleh orbital-orbital. Orbital-orbital dengan kesamaan energi menciptakan sub-kulit. Beberapa sub-kulit membentuk kulit.
Thomson, Goldstein, Rutherford, Bathe, Becker dan Chawdwick merupakan beberapa ilmuwan peneliti sifat kelistrikan atom.
Partikel Penyusun Atom
Proton
Eugene Goldstein (1886) bereksperimen dengan memodifikasi tabung sinar katode (hasil penemuan William Crookes) dengan membuat lubang di lempeng katode dan menemukan bahwa gas di belakang katode berpijar yang berarti bahwa radiasi anode menembus lempeng katode melalui lubang yang sudah dibuat sebelumnya. Sinar anode mempunyai sifat :
- Termasuk radiasi sebab bisa memutar baling-baling.
- Jika radiasi dibelokkan dengan medan magnet akan mengarah ke kutub negatif yang berarti radiasi sinar tersebut bermuatan positif.
- Partikel sinar anode dipengaruhi jenis gas dalam tabung.
Hidrogen memiliki massa proton terkecil (1 proton = 1 sma = 1,66 x 10-24 gram dan muatan 1 proton = +1 = 1,6 x 10-19 C).
Elektron
Josep John Thomson (1897) bereksperimen dengan tabung sinar katode dengan dua buah plat elektroda yang salah satunya ada di ujung tabung dengan fungsi sebagai katoda. Kedua plat diletakkan dalam tabung kaca dengan tekanan rendah lalu dialiri listrik dengan tegangan tinggi sehingga bisa elektron terlepas dari katoda menuju anoda.
Sinar katoda tidak tampak oleh mata telanjang namun bisa diketahui dengan penjaran lapisan bagian dalam tabung kaca akibat benturan elektron-elektron di dinding tabung. Dapat juga dilihat dengan membentur layar berpendar yang berlubang plat logam anodanya.
Sifat Sinar Katoda
Berdasarkan penelitian tersebut, maka diketahui sifat sinar katoda adalah :
- Termasuk radiasi partikel sebab bisa memutar baling-baling.
- Jika radiasi dibelokkan dengan medan magnet akan mengarah ke kutub magnet positif yang berarti sinar katode bermuatan negatif.
- Rambatan partikel katoda tegak lurus terhadap lempeng katode ke anode.
- Tidak bergantung dengan jenis plat logam yang dipakai.
- Bisa dibuat dari listrik bertegangan tinggi.
Thomson menamakan partikel penyusun atom dengan muatan menjadi elektron dan mengetahui perbandingan muatan elektron dengan massa (1,76 x 108 C/g). Robert Millikan (1909) menemukan besar muatan elektron (1,6 x 10-19 C) sehingga massa 1 elektron = 9,1095 x 10-31 kg.
Neutron
Fakta massa inti atom akan selalu lebih besar dibandingkan proton menginspirasi para ilmuwan berhipotesa bahwa ada partikel lain selain proton dalam inti atom dengan muatan netral.
Becker dan W. Bothe (1930) menembakkan partikel alpha ke inti atom berilium dan menemukan radiasi partikel dengan daya tembus besar. James Chadwick (1932) melanjutkan penelitian dan menemukan partikel tersebut memiliki muatan netral serta massanya hampir sama dengan proton (muatan positif). Partikel tersebut disebut neutron.
Demikian penjelasan materi Teori Atom Menurut Para Ahli dan Partikel Penyusun Atom. Terima kasih sudah membaca artikel dan semoga para pembaca semakin paham dengan teori-teori model atom. 🙂